
오늘, 내일은 3월 모의고사가 있으니 2022년 3급 1오답률 상위 5개를 알아보겠습니다.
파트 1. 물리학
지난해 물리 1학년 삭감은 38점으로 매우 낮았다.
5. 13호(전자기 유도)

13번은 전자기 유도 문제로 인해 상당히 쉬운 문제였습니다.
전자기 유도는 변화의 반대 방향(변화를 일정하게 유지하는 방향)으로 작용한다는 점을 기억하세요!
S를 P와 Q의 면적으로 하고,
가다. 자기장 진입 영역 1(I)의 세기가 감소함에 따라 진입 방향으로 자기장이 생성된다.
너. Q는 1에서 절반, 2에서 절반입니다. i에서 자기장의 세기가 감소하는 비율과 ii에서 자기장의 세기가 증가하는 비율이 같기 때문에 Q로 정의되는 자기장의 크기(총 자기 field * area) 흐르는 자속 상수이므로 유도 전류가 없다(변화 X).
Tun.자속(B*S)은 P의 경우 2.5B0*(0.5S)이고 Q의 경우 1.5B0*(0.5S)+2.5B0*(0.5S)로 Q보다 큽니다.
대답은 5입니다
4. #20(에너지 절약)

시간 부족으로 풀지 못했을 확률이 높음
용수철이 L만큼 감소하고 탄성 위치 에너지가 EP이면,
7L 증가 시 에너지 변화
-7W=(16EP-9EP)-7mgL
돌아올 때의 에너지 변화
-4W=-16EP+4mgL
뭉쳐서 정리합시다.
W=0.6mgL
대답은 4입니다
3. 6호(열역학)

가다. A가 흡수하는 열의 양이 크다.
너. 기체가 한 일은 그래프의 면적입니다. ii에서 더 많은 일을 했기 때문에 방출되는 열의 양은 i에서 더 큽니다.
열기관의 열효율은 기체/기체가 흡수한 열이 하는 일이므로 ii의 열효율이 높다.
대답은 2
2. 18호(상대성이론)

4. 조명이 ct2 이동했습니다. 이것은 ct2가 광원과 q 사이의 거리보다 크기 때문에 정확합니다.
t1 < t2는 관성계 B에서 더 많이 움직이는 것 같습니다. 2. 거리는 2ct1입니다. 3. 빛의 이동거리인 ct2보다 길다. 5. A는 B보다 빠르게 운전하고, A는 B보다 느리게 운전합니다. 1위 #15(메카닉)
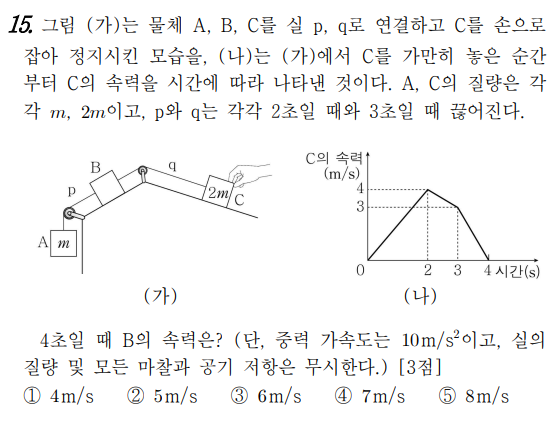
왼쪽(+) 방향으로 가속
B의 질량을 M, B에만 작용하는 힘을 F라 하자. (B만 독립인 경우)
2초까지의 가속도는 2m/s2, 2초에서 3초까지의 가속도는 -1m/s2, 3초에서 4초까지의 가속도는 -3m/s2입니다.
3-4초 후 C는 혼자 훈련합니다. C에 작용하는 순 힘의 크기는 3m/s2*2m=6m입니다.
A에 작용하는 무게는 mg = 10m입니다.
~2초 동안 운동 방정식을 설정하고 2-3초 동안 운동 방정식을 설정합니다.
~2초에서 가속도는 2m/s2이고 A, B 및 C는 움직입니다.
4m+F=(3m+M)*2m/s2
2~3초에 가속도는 -1m/s2 B와 C가 움직이고 있습니다.
6m-F=(2m+M)*1m/s2
연합에 동의하다
남=(2/3)m
에프=(10/3)m
가속도는 5m/s2
줄이 끊어진 후 1초 후인 4초에서 B의 속도는
3+5=8m/초
파트 2. 화학
1급 컷은 47점이었다.
#5 #7 (산화, 환원)

가다. a에서는 O의 산화수가 0에서 -2로 변하여 환원되었다. -> 산화제
너. Mn의 산화수는 +7에서 +2로 감소합니다.
반응물: -2*4 + Mn 산화수 = -1
ca = 5, b = 2 (감소된 산화수의 크기는 증가된 산화수의 크기와 같다. 화학 반응식의 계수를 일치시킨다.)
4. #13(몰 농도)

(a)에서 A의 몰수 = 0.1 mol
0.1L*xM=0.1
x=1
(B)에서 A의 몰수 = 0.025mol
0.2L*yM=0.025
y=0.125
(c)에서 A의 몰수
= 0.3M * 0.2L
= 1M*0.05L+0.125M*V/1000
V=80
대답은 1이다
#3 #17(몰수, 공식 중량)
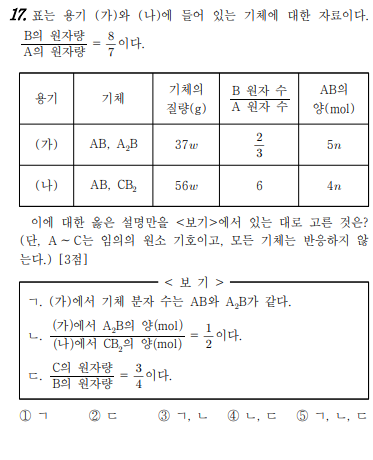
가다. (a)에서 AB가 5n이고 B 원자 수와 A 원자 수의 비율이 2:3이면 A2B는 AB 수인 5n입니다.
너. (b)에서 A 원자의 수는 4n이므로 B의 원자 수는 24n이고 CB2의 양은 10n임을 알 수 있다.
A의 원자량은 7m, B의 원자량은 8m, C의 원자량은 x이다.
(A):(B) 질량비 = (7m+8m)*5n+(2*7n+8m)5n:(7m+8m)*4n+(2*8m+x)*10n=37:56
x=6m
대답은 5입니다
2. 19호(화학 반응)
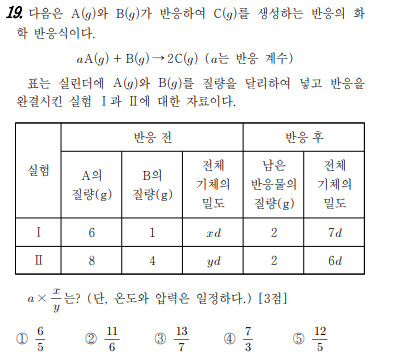
항상 발생하는 화학 반응식의 종류
i에 남아 있는 반응물이 2g이므로 제한 반응물은 B입니다. 반응된 A의 질량은 4g입니다. 반응 질량비도 4:1:5로 구할 수 있습니다. (질량 보존 법칙을 이용하여)
5g의 C가 i에서 형성된다.
ii에서 반응물과 잔류물은 같은 방법으로 얻을 수 있다.
ii에서 모든 A가 반응하면 2g B가 남고 10g C가 생성됩니다.
질량은 i에서 7g, ii에서 12g입니다. 밀도 = 질량/부피이면 부피비 = 몰비 = 1:2입니다.
B의 공식 중량은 2입니다. C의 공식 중량은 5이고 A의 공식 중량은 8/a입니다.
i=2/(8/a), 1에서 A와 C의 몰수
ii에서 B와 C의 몰수 = 1.2
몰의 비율 = 1:2로 비례 공식을 설정해 봅시다.
2g/(8/a)+1:1+2 = 1:2
a=2
반응 전 기체의 몰수는
1.5+0.5 : 2+2=(7/x) : (12/년)
x:y=7:6
대답은 4입니다
#1 #20 (중화 반응)
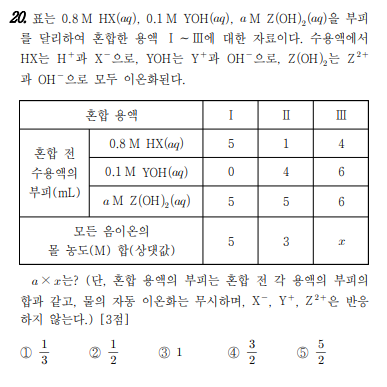
중화 반응
반응 전에 이온의 수를 찾으십시오. (주석의 표)
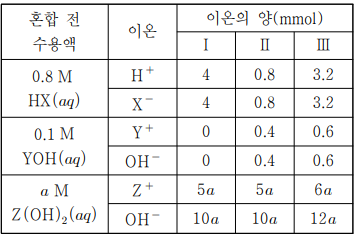
케이스를 나누어야 하는 부분이 있습니다. (잔인한 3가지…)
여기서 i는 산성이고 ii는 염기성이라는 느낌이 강할 것입니다.
실제 시험에서 이렇게 하는 것이 맞습니다(감각이 있어야 합니다).
그것이 무엇이든…
모든 음이온의 몰농도의 합은
i:ii= 4/10 : (0.8+(10a+0.4-0.8))/10=5:3
a=0.2
음이온 몰랄리티의 합
i:iii= 4/10 : 3.2/16 = 5 : 티
x=2.5
대답은 2
i가 산성이고 ii가 염기성인 이유를 아래에 첨부하겠습니다.

오늘은 2022년 3월 물리화학1 모의고사에서 오답률이 높은 문제를 풀었습니다. 다음 시간에 소거법에 대해 알아봅시다.